Pada
kimia organik maupun kimia anorganik, substitusi nukleofilik adalah suatu
kelompok dasar reaksi substitusi, dimana sebuah nukleofil yang kaya elektron
secara selektif berikatan dengan atau menyerang muatan positif dari sebuah
gugus kimia atau atom yang disebut dengan gugus lepas (leaving group).
Bentuk
umum reaksi ini adalah
Dengan
Nu menandakan pasangan elektron, serta RX menandakan subrat dengan gugus pergi
X. Pada reaksi tersebut pasangan elektron dari nukleofil menyerang subrat
membentuk ikatan baru, sementara gugus pergi melepaskan diri bersama dengan
sepasang elektron. produk utamanya adalah R-Nukleofil. Nukleofil dapat memiliki
ikatan negatif ataupun netral, sedangkan subrat biasanya netral atau bermuatan
positif.
suatu gugus pergi adalah suatu molekul
yang lepas dengan suatu pasangan elektron dalam pembelahan ikatan kimia secara
heterolitik. Gugus pergi dapat berupa suatu anion atau molekul netral, tetapi
dalam kedua kasus tersebut yang terpenting adalah bahwa gugus pergi dapat
menstabilkan kerapatan elektron tambahan yang dihasilkan dari heterolisis
ikatan. Gugus pergi anionik yang umum adalah halida seperti Cl−, Br−, dan I−,
serta ester sulfonat seperti tosilat (TsO−). Fluorida (F−) berfungsi sebagai
gugus pergi dalam agen saraf gas sarin. Gugus pergi yang merupakan molekul
netral yang umum adalah air dan amonia.
Sifat
gugus pergi:
1. Gugus pergi yang baik adalah
anion stabil (basa konjugat) dan turunan dari asam kuat. Gugus pergi yang baik
biasanya adalah basa lemah. Halida merupakan gugus pergi yang baik karena ion –
ion ini merupakan basa yang sangat lemah. Contoh: - Ion halida Yaitu I-, Cl-,
Br-. - Turunan asam organic kuat dan terstabilkan oleh resonansi.
contoh
contoh
|
Br adalah Gugus
pergi yang baik
2. gugus pergi yang buruk adalah
gugus –OH pada alcohol sehingga tidak bias digantikan oleh Nukleofil sehingga
harus diubah menjadi gugus lain seperti:
contoh
contoh
|
OH adalah gugus pergi yang jelek
Kemampuan
gugus pergi menunjukkan perbedaan energi antara bahan pemula dan keadaan
transisi (ΔG‡), dan perbedaan dalam kemampuan gugus pergi tercermin dalam
perubahan kuantitas ini (ΔΔG‡). Kuantitas pKaH, namun, menunjukkan perbedaan
energi antara bahan pemula dan produk (ΔG) dengan perbedaan keasaman tercermin
dalam perubahan kuantitas ini (ΔΔG). Juga, bahan pemula dalam kasus ini
berbeda. Dalam kasus pKa, "gugus pergi" terikat dengan proton dalam
bahan pemula, sedangkan dalam kasus kemampuan gugus pergi, gugus pergi terikat
dengan (biasanya) karbon. Hal ini dengan peringatan yang penting diketahui
bahwa seseorang harus mempertimbangkan pKaH agar mencerminkan kemampuan gugus
pergi, namun bagaimanapun setiap tren cenderung berkorelasi dengan baik dengan
satu sama lain. Konsisten dengan tabel berikut ini, basa kuat seperti OH−, OR−
dan NR2− cenderung membuat gugus pergi yang buruk, karena ketidak mampuan mereka
untuk menstabilkan muatan negatif.
gugus
seperti H− (hidrida) dan R3C− (alkil anion, R=alkil atau H)merupakan gugus yang
sangat jarang untuk lepas dengan sepasang elektron hal ini dikarena basanya
yang tidak stabil.
Kemungkinan
suatu gugus digantikan oleh gugus lain tergantung pada kebasaan relatif dari
kedua gugus. Semakin lemah kebasaan suatu gugus, kemampuan untuk pergi lebih baik.
Basa lemah adalah yang baik karena basa lemah tidak bisa berbagi elektron
mereka seperti yang dilakukan oleh basa kuat. Nilai pKa asam konjugasi dari
gugus pergi berbagai senyawa karbonil tercantum pada Tabel berikut. Perhatikan
bahwa kelompok asil Kelas I senyawa karbonil melekat pada basa lemah dibanding
kelompok asil senyawa karbonil Kelas II. Semakin rendah nilai pKa, berarti
semakin asam dan makin lemah basa konjugasinya.
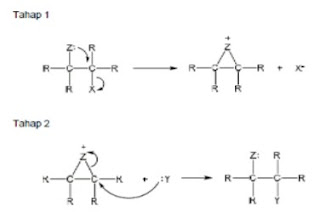
Gugus tetangga
partisipasi
gugus tetangga didefinisikan sebagai gugus yang memberikan suatu reaksi
intermediate yang baru pada pusat reaksi. Untuk reaksi substitusi seperti
dibawah, X sebagai gugus tetangga berperan dalam penyerangan nukleofilik
intramolekul sehingga melepaskan Y sebagai gugus pergi, yang kemudian diikuti oleh
substitusi intermolekul.
Hasil
dari partisipasi ini ialah pembentukan produk substitusi dengan konfigurasi
yang berlawanan dengan konfigurasi yang seharusnya terjadi pada S N 2, dimana
reaksi SN2 pada umumnya membentuk konfigurasi yang berlawanan dengan substrat.
Dengan adanya partisipasi gugus tetangga, konfigurasi produk sama dengan
substrat.
Kadang
ditemukan pada substrat tertentu yang (1) kecepatan reaksinya lebih besar
daripada yang diharapkan, dan (2) konfigurasi pada atom kiralnya dipertahankan,
bukan inversi atau rasemisasi. Hal ini biasa terjadi jika terdapat gugus
yang mempunyai pasangan elektron
tak-dipersahamkan (pasangan elektron bebas). Mekanisme yang bekerja dalam hal
demikian disebut mekanisme partispasi gugus tetangga, terdiri atas dua
substitusi SN2 yang masing-masing menyebabkan inversi sehingga hasilnya adalah
penahanan konfigurasi. Tahap pertama reaksi ini adalah gugus tetangga bertindak
sebagai nukleofil yang memaksa gugus-pergi untuk keluar, tapi tetangga tersebut
masih tetap bertahan terikat pada atom karbon di mana gugus-pergi terikat
sebelumnya. Di dalam tahap kedua, nukleofil eksternal mengusir gugus tetangga
melalui serangan dari arah belakang.
Kecepatan
reaksi yang teramati adalah lebih cepat daripada jika Y menyerang secara
langsung. Hal ini karena jika reaksi di mana Y menyerang secara langsung adalah
reaksi yang lebih cepat maka reaksi itulah yang seharusnya terjadi, namun fakta
yang diperoleh tidak mendukung untuk terjadinya reaksi tersebut. Hukum kecepatan
reaksi dalam mekanisme partisipasi gugus-tetangga adalah order satu, Y tidak
mengambil bagian dalam tahap penentu kecepatan reaksi.
Pertanyaan
yang mungkin muncul adalah mengapa serangan Z lebih cepat daripada serangan Y.
Jawabannya adalah gugus Z lebih tersedia pada posisi yang tepat; sedangkan
untuk bereaksi dengan Y, Y harus bertumbukan dengan substrat. Reaksi antara
substrat dengan Y melibatkan penurunan entropi aktivasi yang besar (ΔSǂ) karena
dalam keadaan transisi, reaktan jauh kurang bebas daripada sebelumnya. Reaksi Z
melibatkan pelepasan ΔSǂ
yang jauh lebih
kecil.
1.
C=C
sebagai gugus tetangga
Bukti
yang kuat bahwa gugus C=C dapat bertindak sebagai gugus tetangga adalah
asetolisis senyawa 8 lebih cepat 1011 kali daripada senyawa 9, dan berlangsung dengan
mempertahankan konfigurasi. Data kecepatan reaksi sendiri bukanlah menjadi
bukti penting bahwa asetolisis tersebut melibatkan karbokation non-klasik
sebagai spesies-antara, tapi adalah bukti yang kuat bahwa gugus C=C membantu
perginya gugus OTs. Bukti yang kuat untuk kebedaan karbokation non-klasik
datang dari studi NMR kation norbornaldienil (10) yang relatif stabil. Spektrum
spesies kimia tersebut memperlihatkan proton 2 dan 3 tidak ekuivalen dengan
proton 5 dan 6.
Jadi
ada interaksi antara karbon bermuatan dengan satu ikatan rangkap dua, yang mana
dapat dijadikan bukti untuk keberadaan ion non-klasik yang analog dengannya.
2. Siklopropil sebagai gugus tetangga
Sebagaimana
telah diketahui bahwa cincin siklopropana mempunyai kemiripan sifat dengan
ikatan rangkap dua. Oleh karena itu, tidaklah menherankan jika cincin yang
berada pada posisi yang tepat maka dapat berpartisipasi sebagai gugus tetangga.
Sebagai contoh adalah solvolisis endo-anti-trisiklo-[3.2.1.0]oktan-8-il
p-nitrobenzoat (senyawa 11) lebih sekitar 1014 kali lebih cepat daripada
senyawa 12.
Tampaknya
cincin siklopropil yang ada pada posisi yang tepat dapat lebih efektif sebagai
gugus tetangga daripada ikatan rangkap dua. Perlunya penekanan tentang posisi
yang tepat terbukti dengan fakta kecepatan solvolisis senyawa 14 hanya sekitar
lima kali lebih cepat daripada senyawa 13, sedangkan solvolisis senyawa 15
sekitar tiga kali lebih lambat daripada solvolisis senyawa 13.
3. Cincin aromatik sebagai gugus tetangga
Banyak
sekali bukti bahwa cincin aromatik dalam posisi
dapat berfungsi sebagai gugus tetangga yang
dapat berpartisipasi. Bukti secara stereokimia diperoleh melalui solvolisis
L-treo-3-fenil-2-butil tosilat (senyawa 16) di dalam asam asetat. Jika
solvolisis dijalankan di dalam asam format maka lebih sedikit lagi isomer
eritro yang diperoleh. Hasil ini mirip dengan yang ditemukan pada reaksi
3-bromo-2-butanol dengan HBr, dan hal ini mengarahkan kepada kesimpulan bahwa
konfigurasi dipertahankan karena fenil bertindak sebagai gugus tetangga yang
dapat berpartisifasi.
Pertanyaan
1. Kenapa basa lemah merupakan
gugus pergi yang baik ? dan kenapa gugus R- dan R3C- sangat jarang untuk lepas dengan
pasangan elektron ?
2. dari reaksi tersebut mana yang bertindak sebagai gugus pergi dan gugus tetangga
3. pada reaksi tahap kedua kenapa serangan z lebih cepat daripada serangan y
4. bagaimana kehadiran gugus tetangga memberikan pengaruh terhadap reaksi substitusi nukleofilik ?
Daftar pustaka
Firdaus. 2013. Kimia Organik Fisik II. Makasar : Universitas Hasanuddin.
Imyanitov, Naum S. (1993).
"Is This Reaction a Substitution, Oxidation-Reduction, or Transfer". Journal Chemistry Education. 70 (1):
14–16.
subandi.2010. kimia organik. Yogyakarta : Deepublish.